Lääketeollisuudessa eletään säännellyssä maailmassa. Jotta säännellyn maailman sääntöjä noudatetaan, on aina välillä hyvä tarkastaa, että kaikki myös tekevät sääntöjen ja ohjeistusten mukaan. Tarkastuksia tekevät viranomaiset ja auditointeja suorittavat yleensä yrityksen lääketurvajärjestelmän ulkopuoliset tahot. Sääntöihin ja määräyksiin ei tässä puututa, koska ne kaikki ovat löydettävissä netin ihmeellisestä maailmasta.
Viranomaiset julkaisevat tietoa siitä, millaisia havaintoja lääketurvatarkastusten yhteydessä tulee esille. UK:n lääkeviranomaisen, MHRAn 4.9.2023 julkaiseman raportin mukaan ajalta huhtikuu 2021-maaliskuu 2022 MHRA teki 32 lääketurvatoiminnan tarkastusta. Näissä tarkastuksissa oli kuusi kriittistä, 72 isoa ja 91 pientä havaintoa.
Tarkastusten havainnot jakautuivat raportin mukaan seuraavasti:
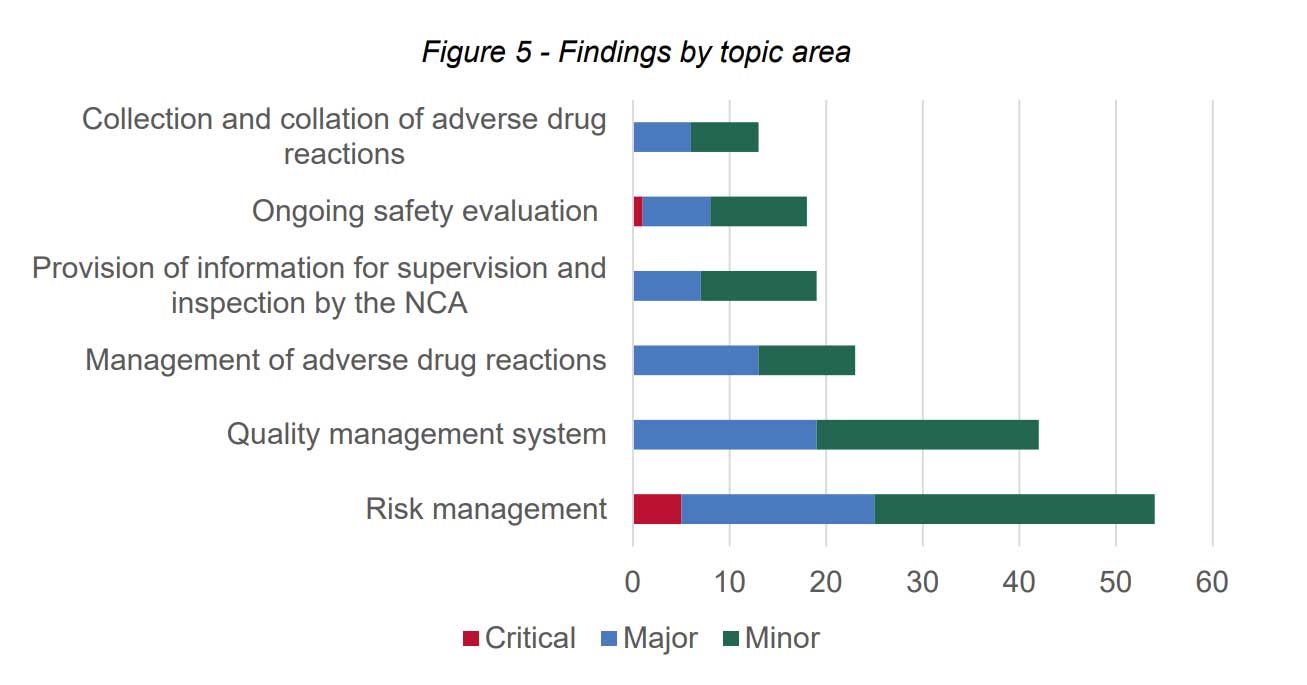
Muutamien esimerkkien mukaan riskinhallinnan kriittisiä havaintoja olivat
- Lääkkeen pakkausselosteesta puuttui lääkkeen turvallisuuteen liittyviä tietoja, joita ei ollut päivitetty pakkausselosteeseen. Tällä oli vaikutus potilasturvallisuuteen.
- Myyntiluvan haltijan nettisivuilla ei ollut uusimpia päivitettyjä lääkkeen tuotetietoja eikä pakkausselostetta ollut päivitetty ajantasaiseksi.
Euroopan lääkevirasto (EMA) julkaisee vuosittaista raporttia, jossa on mukana EMAn tekemät lääketurvatoiminnan tarkastusten lukumäärät.
Tarkastukset ja auditoinnit ovat hyvä tilaisuus peilata omaa lääketurvatoimintaa ja miettiä, mikä on haasteellista, mikä on hyvin ja mitä pitää petrata.
Viitteet:
Medicines and Healthcare products Regulatory Agency: Pharmacovigilance Inspection Metrics Report April 2021 – March 2022
Assessed 20 Oct 2023 https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1182091/MHRA_GPvP_inspection_metrics_2021-22.pdf
European Medicines Agency: Annual Report 2022
Assessed 20 Oct 2023 https://www.ema.europa.eu/en/annual-report/2022/inspections-and-compliance.html


